
Back Swaelsuur Afrikaans حمض الكبريتيك Arabic حمض كبريتي ARY Ácidu sulfúrico AST Sulfat turşusu Azerbaijani سولفوریک اسید AZB Серная кіслата Byelorussian Серчаная кісьля BE-X-OLD Сярна киселина Bulgarian সালফিউরিক অ্যাসিড Bengali/Bangla
| Acide sulfurique | |
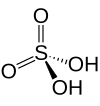    Structure de l'acide sulfurique. |
|
| Identification | |
|---|---|
| Nom UICPA | acide sulfurique sulfate d'hydrogène |
| No CAS | |
| No ECHA | 100.028.763 |
| No CE | 231-639-5 |
| No RTECS | WS5600000 |
| PubChem | 1118 |
| ChEBI | 26836 |
| No E | E513 |
| SMILES | |
| InChI | |
| Apparence | liquide hygroscopique, huileux, incolore, inodore[1] |
| Propriétés chimiques | |
| Formule | H2SO4 |
| Masse molaire[3] | 98,078 ± 0,006 g/mol H 2,06 %, O 65,25 %, S 32,69 %, |
| pKa | –3,0 et 1,9 |
| Moment dipolaire | 2,72 D[2] |
| Diamètre moléculaire | 0,487 nm[2] |
| Propriétés physiques | |
| T° fusion | 100 % : 10,31 °C 98 % : 3 °C |
| T° ébullition | (décomposition) : 337 °C[1] |
| Paramètre de solubilité δ | 25,6 J1/2·cm-3/2 (25 °C)[2] |
| Miscibilité | Miscible avec l'eau et l'alcool (réaction exothermique)[4] |
| Masse volumique | 1,830 2 g·cm-3[4] |
| Thermochimie | |
| S0liquide, 1 bar | 19 J K−1 mol−1[réf. souhaitée] |
| ΔfH0liquide | −814 kJ mol−1[réf. souhaitée] |
| Propriétés optiques | |
| Indice de réfraction | 1,4184[2] |
| Précautions | |
| SGH[5],[6] | |
| H290, H314, P280, P309, P310, P301+P330+P331 et P305+P351+P338 |
|
| SIMDUT[7] | |
  D1A, E, |
|
| NFPA 704 | |
| Transport[6] | |
| Inhalation | Très dangereux : les vapeurs peuvent être mortelles. |
| Peau | Provoque de graves brûlures. |
| Yeux | Provoque de graves brûlures. |
| Ingestion | Toxique : provoque de graves brûlures pouvant être mortelles. |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,15 ppm[8] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|


L’acide sulfurique, appelé jadis huile de vitriol ou vitriol fumant, est un composé chimique de formule H2SO4. C'est un acide minéral dont la force (pKa = –3,0) est seulement dépassée par quelques superacides. Il est miscible à l'eau en toutes proportions, où il se dissocie en libérant des cations hydronium :
L'acide sulfurique est un produit industriel de première importance, qui trouve de très nombreuses applications, notamment dans les batteries au plomb pour les voitures et autres véhicules, le traitement des minerais, la fabrication des engrais, le raffinage du pétrole, le traitement des eaux usées et les synthèses chimiques.
Issu de l'hydratation du trioxyde de soufre SO3, lui-même résultant de l'oxydation naturelle du dioxyde de soufre SO2 dans l'atmosphère terrestre où il est un polluant notoire, l'acide sulfurique est présent dans les pluies acides.
Sa grande corrosivité et les dangers qu'il représente ne sont pas tant dus à sa nature d'acide fort qu'à son avidité pour l'eau qui en fait un agent utilisé en dessiccation, capable de brûler gravement les tissus organiques. C'est la raison pour laquelle, au même titre que la soude caustique, il est beaucoup plus dangereux que l'acide chlorhydrique qui est pourtant également un acide fort.
Il est le composant principal des nuages de la planète Vénus.
- ACIDE SULFURIQUE, Fiches internationales de sécurité chimique
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Sulfuric Acid », sur Hazardous Substances Data Bank (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Entrée « Sulfuric acid solution » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12 juin 2011 (JavaScript nécessaire)
- « Acide sulfurique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Sulfuric acid », sur hazmap.nlm.nih.gov (consulté le )



