Back بيروكسيد عضوي Arabic জৈব পারঅক্সাইড Bengali/Bangla Peròxid orgànic Catalan Organický peroxid Czech Organisk peroxid Danish Organische Peroxide German Οργανικά υπεροξείδια Greek Organic peroxides English Peróxido orgánico Spanish Peroxido organiko Basque

En chimie organique, les peroxydes organiques sont des composés organiques contenant le groupe fonctionnel peroxyde (R-O-O-R'). Si le R′ est de l'hydrogène, de tels composés sont appelés hydroperoxydes. La liaison O−O des peroxydes se brise facilement, produisant des radicaux libres de la forme RO. (le point représente un électron célibataire). Ainsi, les peroxydes organiques sont utiles comme amorceurs pour certains types de polymérisation, tels que les résines acryliques, polyesters insaturés et vinylesters utilisés dans les plastiques à renfort de verre. Le MEKP et le peroxyde de benzoyle sont couramment utilisés à cette fin. Cependant, cette même propriété signifie également que les peroxydes organiques peuvent s’enflammer de manière explosive. Les peroxydes organiques, comme leurs homologues inorganiques, sont souvent de puissants agents de blanchiment[1].
Les peroxydes organiques sont classés (i) selon la présence ou l'absence d'une extrémité hydroxyle (-OH) et (ii) selon la présence de substituants alkyle ou acyle[2].
- Exemples de peroxydes organiques
-
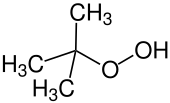
Hydroperoxyde de tert-butyle, un hydroperoxyde (formule : ROOH), qui est utilisé pour époxyder les alcènes.
-
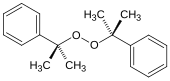
Peroxyde de dicumyle, un peroxyde de dialkyle (formule : ROOR), qui est utilisé pour initier les polymérisations.
-
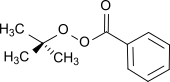
tert-butylperoxybenzoate, un peroxyester (formule : RCO3R') utilisé comme amorceur de radicaux.
-
peroxyde de dibenzoyle, un peroxyde de diacyle (formule : (RCO2)2) est également utilisé comme amorceur de polymérisations.
-
Acide peroxyacétique, un acide peroxycarboxylique[formule : (RCO3H)], est un réactif en synthèse organique.
Une lacune dans les classes de peroxydes organiques est le peroxyde de diphényle. Les calculs de chimie quantique prédisent qu'il subit une réaction très proche du mécanisme de réarrangement de la benzidine[3].
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a19_199.pub2), « Peroxy Compounds, Organic »
- PATAI'S Chemistry of Functional Groups: Peroxides, Wiley, (ISBN 9780470771730)
- « Henry Rzepa's Blog: Why diphenyl peroxide does not exist. »