
Back Koolstofmonoksied Afrikaans Monoxido de carbonio AN أحادي أكسيد الكربون Arabic Monóxidu de carbonu AST Karbon monoksid Azerbaijani کربون مونوکسید AZB Smalkē BAT-SMG Въглероден оксид Bulgarian कार्बन मोनोऑक्साइड Bihari কার্বন মনোক্সাইড Bengali/Bangla
| Monossido di carbonio | |
|---|---|
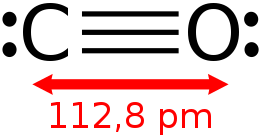 | |
 | |
| Nome IUPAC | |
| monossido di carbonio | |
| Nomi alternativi | |
| ossido di carbonio (II) ossido di carbonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CO |
| Massa molecolare (u) | 28,04 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 211-128-3 |
| PubChem | 281 |
| DrugBank | DB11588 |
| SMILES | [C-]#[O+] |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,145 |
| Solubilità in acqua | 0,028 g/l a 293 K |
| Temperatura di fusione | −205 °C (68 K) |
| Temperatura di ebollizione | −192 °C (81 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −110,5 |
| ΔfG0 (kJ·mol−1) | −137,21 |
| S0m(J·K−1mol−1) | 197,7 |
| C0p,m(J·K−1mol−1) | 29,1 |
| Indicazioni di sicurezza | |
| Limiti di esplosione | 12,5 - 74% vol. |
| Temperatura di autoignizione | 605 °C (878 K) |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 331 - 220 - 360d - 372 - 280 |
| Consigli P | 260 - 210 - 202 - 304+340 - 308+313 - 377 - 381 - 405 - 403 [1] |
Il monossido di carbonio (o ossido di carbonio o ossido carbonioso) è un gas incolore, inodore e insapore, leggermente meno denso dell'aria. Se presente in concentrazioni superiori a circa 35 ppm risulta altamente tossico per gli animali, sia vertebrati che invertebrati, che usano l'emoglobina per trasportare l'ossigeno all'interno dell'organismo; in piccole quantità viene tuttavia prodotto dal normale metabolismo animale e si ritiene svolga alcune normali funzioni biologiche. La sua formula chimica è CO, cioè la sua molecola è formata da un atomo di carbonio e uno di ossigeno legati con triplo legame.
La sua concentrazione nell'atmosfera è variabile e ricopre un ruolo nella formazione dell'ozono a livello del suolo: si miscela bene nell'aria, con la quale forma facilmente miscele esplosive; in presenza di polveri metalliche finemente disperse, forma metallocarbonili tossici e infiammabili; può reagire vigorosamente con ossigeno, acetilene, cloro, fluoro, ossidi di azoto.[2]
Viene prodotto da reazioni di combustione in difetto di aria (cioè quando l'ossigeno presente nell'aria non è sufficiente a convertire tutto il carbonio in anidride carbonica[3]), per esempio negli incendi di foreste e boschi, dove il prodotto principale della combustione rimane comunque l'anidride carbonica; altre fonti naturali sono i vulcani, mentre la maggior parte si genera da reazioni fotochimiche che avvengono nella troposfera; inoltre si sprigiona durante le combustioni in ambienti chiusi[3] e dalle vecchie stufe a gas liquido, responsabili dell'alta frequenza di intossicazione da monossido di carbonio in caso la stufa non abbia efficiente aerazione.[3]
- ^ scheda del monossido di carbonio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Fonte: "Schede Internazionali di Sicurezza Chimica ICSC0023 Archiviato il 14 novembre 2010 in Internet Archive."
- ^ a b c Corriere della Sera - Monossido di carbonio