
Back Tetrachloormetaan Afrikaans رباعي كلوريد الكربون Arabic Tetraxlormetan Azerbaijani کربون تتراکولورید AZB Тетрахлорметан Bulgarian কার্বন টেট্রাক্লোরাইড Bengali/Bangla Tetraclorur de carboni Catalan Tetrachlormethan Czech Tetraklorkulstof Danish Tetrachlormethan German
| Tetracloruro di carbonio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| tetraclorometano | |
| Nomi alternativi | |
| tetracloruro di carbonio
perclorometano | |
| Caratteristiche generali | |
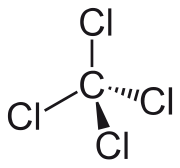
| Formula bruta o molecolare | CCl4 |
| Peso formula (u) | 153,8 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-262-8 |
| PubChem | 5943 |
| SMILES | C(Cl)(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,594 |
| Solubilità in acqua | 0,8 g/l a 293 K |
| Temperatura di fusione | −23 °C (250 K) |
| Temperatura di ebollizione | 77 °C (350 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −128,2 |
| S0m(J·K−1mol−1) | 216 |
| C0p,m(J·K−1mol−1) | 130,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 301+311+331 - 317 - 351 - 372 - 412 - 420 |
| Consigli P | 261 - 273 - 280 - 301+310+330 - 403+233 - 502 [1] |
Il tetracloruro di carbonio è un composto binario del carbonio con il cloro, avente formula molecolare CCl4.[2] È noto in chimica organica anche con il nome sistematico tetraclorometano in quanto membro degli alometani tetrasostituiti.[3] In questa molecola l'atomo centrale di carbonio si lega covalentemente a quattro atomi di cloro, raggiungendo così il suo massimo stato di ossidazione (+4), come in CO2, oltre al suo massimo numero di coordinazione (4).
È un composto sintetico e uno dei più tipici solventi apolari,[3] come anche il solfuro di carbonio CS2, rispetto al quale ha il vantaggio di essere chimicamente molto più inerte, ma anche meno volatile. Tuttavia, il suo uso è sempre più in declino a causa della sua pericolosità per la salute e per i suoi effetti dannosi sullo strato di ozono.[4] Il CCl4 è noto anche con le sigle commerciali freon 10, CFC 10, o R-10.
A temperatura ambiente si presenta come un liquido volatile, incolore, non infiammabile, denso (d = 1,594 g/mL), dal caratteristico odore dolciastro, avvertibile anche a basse concentrazioni. In acqua è quasi insolubile (793 mg/L at 25 °C); è completamente miscibile con benzene, cloroformio, etere, solfuro di carbonio, etere di petrolio ed è solubile in alcool e acetone.[5]
È un composto molto tossico perché capace di innescare reazioni a catena radicaliche che degradano le membrane cellulari. Non essendo combustibile, è stato usato in passato negli estintori come liquido di raffreddamento, ma è stato via via sostituito da altri composti per via della sua tossicità.
- ^ scheda della sostanza su [1]
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, pp. 222-223, ISBN 0-471-19957-5.
- ^ a b James E. House, Inorganic Chemistry, Elsevier, 2008, p. 456, ISBN 978-0-12-356786-4.
- ^ Wayback Machine (PDF), su web.archive.org, 27 febbraio 2008. URL consultato il 14 marzo 2023 (archiviato dall'url originale il 27 febbraio 2008).
- ^ (EN) PubChem, Carbon Tetrachloride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 14 marzo 2023.