
Back Kalsium Afrikaans ካልሲየም Amharic Calcio AN कैल्सियम ANP كالسيوم Arabic كالسيوم ARY كالسيوم ARZ Calciu AST क्याल्सियम AWA Kalsium Azerbaijani
| Aquest article tracta sobre l'element químic. Vegeu-ne altres significats a «Calci (Itàlia)». |
| Calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20Ca
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris apagat, argentat Calci sòlid  Línies espectrals del calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Calci, Ca, 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls alcalinoterris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 2, 4, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 40,078(4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 4s2 2, 8, 8, 2 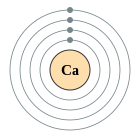
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
1,55 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
1,378 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.115 K, 842 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 1.757 K, 1.484 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 8,54 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 154,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,929 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | +2, +1[1] (òxid bàsic fort) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització (més) |
1a: 589,8 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.145,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 4.912,4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 197 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 176±10 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 231 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 33,6 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 201 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 22,3 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.810 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 7,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 17 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 1,75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 167 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-70-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del calci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El calci és l'element químic de símbol Ca i nombre atòmic 20. Igual que els altres metalls alcalinoterris, és un metall reactiu que forma una capa d'òxid-nitrur de color fosc en ser exposat a l'aire. Les seves propietats físiques i químiques són similars a les dels seus homòlegs més pesants, l'estronci i el bari. Es tracta del cinquè element més abundant a l'escorça terrestre i el tercer metall més abundant, després del ferro i l'alumini. El compost de calci més comú a la Terra és el carbonat de calci, que es pot trobar en la pedra calcària i les restes fòssils d'organismes marins primitius. Entre les altres fonts de calci hi ha el guix, l'anhidrita, la fluorita i l'apatita. El seu nom deriva de calx, el nom llatí de la calç, que s'obtenia escalfant la pedra calcària.
Malgrat que a l'edat antiga ja es coneixien diversos compostos de calci, les seves propietats químiques no es posaren en clar fins al segle xvii. El 1808, Humphry Davy obtingué calci pur mitjançant l'electròlisi del seu òxid i batejà l'element. Els compostos de calci tenen un ús molt ampli en nombroses indústries: com a suplement de calci en el sector alimentari i farmacèutic, com a agent de blanqueig en la indústria paperera, com a component del ciment i els aïlladors elèctrics i en la fabricació de sabó. En canvi, l'alta reactivitat del metall pur fa que no tingui gaire aplicacions; en quantitats petites, és emprat habitualment com a component d'aliatges en la siderúrgia i ocasionalment en aliatges de calci i plom per a la fabricació de bateries per a automòbils.
És un element essencial per a la vida. Es calcula que entre un 1,5% i un 2% del pes d'una persona és calci, del qual el 99% es troba en els ossos i la resta en teixits i líquids corporals intervenint en el metabolisme cel·lular.
En la parla vulgar s'utilitza la veu calci per a referir-se a les seves sals (v.g., 'aquesta aigua té molt calci; en les canonades es diposita molt calci, etc.)
- ↑ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias «Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes». Journal of the American Chemical Society, 132, 35, 2010, pàg. 100818110534020. DOI: 10.1021/ja105534w. PMID: 20718434.